अल्कली धातू व अल्कधर्मी पृथ्वी धातू दरम्यान फरक
आवर्त धातू आणि क्षारयुक्त पृथ्वीच्या धातू या दोन्ही आवर्त सारणीमध्ये पहिल्या दोन गट आहेत, क्षारयुक्त धातू व अल्कधर्मी धरणाच्या धातूंमधील फरक कोणत्याही रसायनशास्त्र विद्यार्थ्यासाठी आवड आहे. अल्कली धातू व अल्कधर्मी धरणाच्या धातूंना "एस-ब्लॉक" घटक देखील म्हटले जाते कारण ह्या दोन्ही गटांतील घटकांमध्ये त्यांचे सर्वात मोठे इलेक्ट्रॉन (एस) एस-सबशेल्डमध्ये असते.
साधारणपणे, आम्ही वीज चालवणाऱ्या साहित्यासाठी "धातु" हा शब्द वापरला; दोन्ही क्षारयुक्त धातू आणि अल्कधर्मी पृथ्वी धातू चांगले विद्युत आणि उष्णता conductors आहेत. नियतकालिक सारणीमध्ये या दोन गटांतील घटक सर्वात जास्त प्रतिक्रियात्मक धातू आहेत. त्यांचे वितळण्याचे गुण इतर धातूंच्या तुलनेत तुलनेने कमी असतात. अल्कली धातू व अल्कधर्मी धरणाच्या धातूंमध्ये समान गुणधर्म असतात परंतु हे लेख प्रामुख्याने त्यांचे मतभेदांविषयी चर्चा करतो.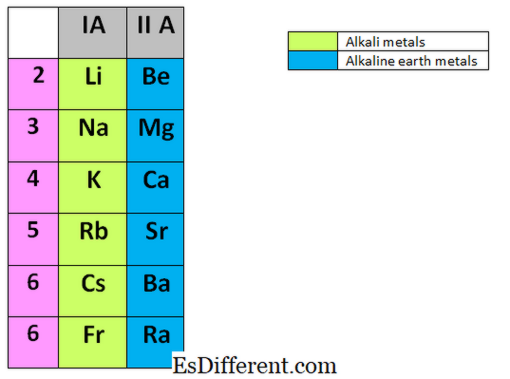
अल्कली धातू म्हणजे नियतकालिक सारणीच्या पहिल्या समूहात आढळणारे घटक. ते लिथियम (ली), सोडियम (ना), पोटॅशिअम (के), रुबिडियम (आरबी), सेझियम (सीएस) आणि फ्रॅन्शिअम (फ्रान्स) आहेत. ते सर्व धातू आहेत आणि अतिशय प्रतिक्रियाशील आहेत आणि या धातूंपैकी कोणतीही प्रकृती निसर्गात मोफत धातू म्हणून येऊ देत नाही. अल्कली धातू नेहमी केरोसिन सारख्या अळंबी द्रवांमध्ये साठवली जातात कारण ते वेगाने हवा, पाण्याची वाफ आणि हवेमध्ये ऑक्सिजनवर प्रतिक्रिया देतात. कधीकधी ते इतर पदार्थांशी विस्फोटकपणे प्रतिक्रिया देतात. व्हॅलेन्स शेलमधील बाह्यतम इलेक्ट्रॉन अवयव काढून ते सहजपणे अष्टवृद्धीचे राज्य साध्य करू शकतात.
लिथियम आणि सोडियमची घनता पाणी घनतांपेक्षा कमी आहे. तथापि, इतर घटक पाणी जास्त घट्ट आहेत. अनेक अल्कली मेटल कंपाउंडस् (NaCl, KCl, Na 2 CO3, NaOH) व्यावसायिकदृष्ट्या अतिशय महत्त्वाचे आहेत. अल्कलीने पृथ्वी धातू काय आहेत? आल्कक्त पृथ्वीच्या धातू नियतकालिक सारणीच्या दुसर्या गटात आढळतात. ग्रुप II घटकांमध्ये; बेरिलियम (बी), मॅग्नेशियम (एमजी), कॅल्शियम (सीए), स्ट्रोन्टियम (एसआर), बारिअम (बा) आणि रेडियम (रा). अल्कधर्मी धातूंप्रमाणे, हे घटक देखील निसर्गात मुक्तपणे होत नाहीत आणि ते देखील अतिशय प्रतिक्रियात्मक असतात.
या गटातील सर्व घटक पाण्यापेक्षा घनतेपेक्षा जास्त आहेत. शुद्ध धातू चांदी-राखाडी रंगाचे असतात, परंतु जेव्हा ते हवेच्या बाहेर पडतात तेव्हा ते त्वरीत निराश होतात कारण ते पृष्ठभागावर ऑक्साईड थर तयार करतात. क्षारयुक्त धातूंप्रमाणे, ही धातू देखील उष्णता आणि वीज यामध्ये चांगले कंडक्टर आहेत.सर्व अल्कधर्मी पृथ्वीच्या धातू व्यावसायिकदृष्ट्या मौल्यवान आहेत. अल्कली मेटल्स आणि अल्कलीने अर्थ मेटल्समध्ये काय फरक आहे?
इलेक्ट्रॉन कॉन्फिगरेशन: अल्कली धातूमध्ये [नोबल गॅस] एनएस 1 आणि अल्कलीने पृथ्वी मेटल्समध्ये इलेक्ट्रॉनिक संरचना आहे, [नोबल गॅस] एनएस 2
इलेक्ट्रॉनिक संरचना.
वॅलेंन्स: सर्व अल्कली धातूंमध्ये त्यांच्या बाह्यतम शंखांत इलेक्ट्रॉन आहे आणि सर्व अल्कधर्मी धरणाच्या धातूमध्ये दोन बाह्य इलेक्ट्रॉन आहेत. उदात्त गॅस संरचना साध्य करण्यासाठी, अल्कली धातूंना एक इलेक्ट्रॉन (व्हॅलेन्स "एक") गमवावे लागते, तर अल्कधर्मी धरणाच्या धातूंना दोन इलेक्ट्रॉनांना काढण्याची आवश्यकता असते (व्हॅलीन्स "दोन").
- प्रतिक्रियात्मकता: क्षारयुक्त धातू आणि अल्कधर्मी धातू दोन्ही अतिशय प्रतिक्रियाशील आहेत. अल्कली धातू ही अल्कधर्मी धरणाच्या धातूंपेक्षा जास्त रिऍक्टिव्ह असतात. आयोनिक शुल्क : अल्कली धातूंमध्ये त्यांच्या संयुगेमध्ये 1 आयनिक चार्ज आहे आणि क्षारयुक्त आकृत्यांच्या धातूमध्ये + 2 संयुगे आयोनिक आकार असतात. कडकपणा : अल्कली धातू अतिशय मऊ असतात आणि ते एका धारदार चाकूने कापता येतात. क्षारीय पृथ्वीच्या धातू अल्कली धातूंपेक्षा कठीण असतात. सारांश:
- अल्कली धातू विरुद्ध अल्कलीने पृथ्वी धातू अल्कली धातू आणि अल्कधर्मी पृथ्वीच्या धातू अनुक्रमे आवर्त सारणीत गट मी आणि गट II घटक आहेत. या दोन गटांमधील सर्वात लक्षणीय फरक म्हणजे इलेक्ट्रॉनिक संरचना आहे. ग्रुप I मधील व्हॅलेन्स शेलमध्ये केवळ एकच इलेक्ट्रॉन आहे आणि समूह II घटकांमध्ये त्यांच्या व्हॅलेंस शेलमध्ये दोन इलेक्ट्रॉन असतात. या दोन गटांमध्ये समान गुणधर्म तसेच काही मतभेद आहेत. या दोन्ही धातूंवरून फक्त साध्या ऑक्सिडेशनची माहिती दिसून येते आणि त्यांचे सर्व रासायनिक संयुगेमध्ये एक स्थिर ऑक्सिडेशन नंबर असतो. ते अतिशय प्रतिक्रियात्मक आहेत आणि मुक्तपणे निसर्गात आढळत नाहीत.