समतोल समीकरणे आणि शुद्ध आयोनिक समीकरणातील फरक
महत्त्वाचा फरक - संतुलित समीकरणे वि नेट आयोनिक समीकरण सर्व रासायनिक अभिक्रियांना समीकरण असे लिहिले जाऊ शकते. या समीकरणाचे घटक म्हणजे त्यांच्या भौतिक अवस्थांसह प्रतिक्रिया करणारे, प्रतिक्रिया निर्देशित करणे आणि त्यांच्या भौतिक अवस्थांसह प्रतिक्रिया देण्याचे उत्पादन दर्शविणारी बाण. कोणत्याही विशिष्ट परिस्थितीचा वापर केल्यास, ते बाणावर थोडक्यात लिहिलेले असते. प्रतिक्रिया समतोल असल्यास, दोन अर्धअम विरुद्ध निर्देशांमध्ये वापरले जातात. रासायनिक समीकरण हे दोन प्रकारे लिहीले जाऊ शकते: समतोल समीकरण किंवा निव्वळ इयनिक समीकरण असे. संतुलित समीकरण आणि नेट इऑनॉनिक समीकरण यात महत्वाचा फरक असा की
संतुलित समीकरण प्रणालीमध्ये सर्व प्रतिक्रियां एकत्रित करते तर निव्वळ इयनिक समीकरण केवळ त्या विशिष्ट समीकरणानंतर घडलेल्या निव्वळ प्रतिक्रिया दर्शवितो प्रतिक्रिया
अनुक्रमणिका1. विहंगावलोकन आणि महत्त्वाचे अंतर
2 एक संतुलित समीकरण 3 काय आहे एक शुद्ध आयोनिक समीकरण 4 काय आहे साइड बायपास बाय साइड - बॅलन्स असे समीकरण vs नेट आयोनिक समीकरण
5 सारांश <एक समतोल समीकरण काय आहे?
एखाद्या विशिष्ट प्रणालीचे व्यवहार समजून घेण्यासाठी रासायनिक प्रतिक्रिया खूप महत्वाच्या असतात. प्रतिक्रियेसाठी योग्य समीकरण लिहून आपण त्या प्रणालीतील विविध प्रजातींचे बदल घडवून आणू शकतो. पाण्यातील NaCl च्या विरघळण्यासारख्या सोप्या प्रतिक्रियांसाठी, त्या अभिक्रियाचे संभाव्य उत्पादनांचे अंदाज घेऊन समीकरण सहजपणे लिहीले जाऊ शकते. परंतु इतर कॉम्प्लेक्स रिऍक्शनसाठी, त्या विशिष्ट सिस्टमची उत्पादने शोधण्यासाठी पुढील चाचण्या कराव्या लागतील. परंतु बर्याच वेळा लेखी समीकरण असंतुलन असण्याची शक्यता आहे, ज्यामुळे त्या प्रणालीचे रासायनिक व्यवहार समजावणे अवघड होते. म्हणून, असमतोल समीकरणे देखील समतोल असावीत. समतोल समीकरण म्हणजे सर्व रिएन्टंट्स आणि त्या प्रणालीचे उत्पादन. अणू म्हणून अभिक्रियाक संयुगाचा विचार करून समीकरण लिहीले आहे. उदाहरणार्थ, केआई आणि पीबीओ
3 (जर त्या पाण्यात प्रतिक्रिया दिली तर) यांच्यातील समतोल समीकरण असेल;
समतोल समीकरणाचा महत्त्वाचा भाग म्हणजे प्रणालीतील प्रजातींच्या दरम्यान स्टोइचीओमेट्रिक संबंधांविषयी तपशील देणारी वाढीव प्रतिक्रिया व्यक्त करणाऱ्या अभिक्रियाकांमधून. उपरोक्त उदाहरणामध्ये, प्रणालीमध्ये त्या घटक जोडताना पीबीओ
3 आणि KI मधील गुणोत्तर 1: 2 असावा. नेट Ionic समीकरण काय आहे? निव्वळ इयनिक समीकरण सिस्टीममध्ये झालेली एकंदर प्रतिक्रिया दर्शवितो. त्यात आयोनिक प्रजाती आणि तयार उत्पादने समाविष्ट आहेत. परंतु त्या विशिष्ट प्रणालीमध्ये घडलेली सर्व प्रतिक्रिया दर्शवीत नाही. उदाहरणार्थ, जर दोन अणुंची एक माध्यम म्हणून पाण्याचा उपयोग होत असेल तर, संयुगे पाण्यात विसर्जित होऊन आयनमध्ये विभाजित होतात. यापैकी काही आयन प्रतिक्रिया मध्ये सहभागी होऊ शकतात पण काही करू शकत नाहीत. नंतर नेट इयनिक समीकरणामध्ये फक्त आयनसचक्र समाविष्ट होते ज्यात शुद्ध अभिक्रियामध्ये भाग घेतला होता. इतर आयन, ज्याला प्रेक्षकांमधे म्हटले जाते, ते निव्वळ इयनिक समीकरण मिळवण्यासाठी समीकरण काढून टाकले जातात. उदाहरणार्थ, जर KI आणि PbNO

पाण्यावर प्रतिक्रिया दिली तर निव्वळ इऑनरिक प्रतिक्रिया असेल;
+
आयन आणि NO3 - आयन समाविष्ट आहे, परंतु त्या आयन केवळ विरघळतील आणि मोठ्या प्रतिक्रियांमध्ये भाग घेऊ नये; त्यामुळे ते शुद्ध इयनिक प्रतिक्रिया मध्ये समाविष्ट नाहीत.
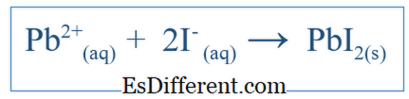
- फरक लेख मध्य सारणी -> संतुलित समीकरणे वि नेट आयोनिक समीकरण वापरलेले सर्व घटक संतुलित समीकरणात अभिक्रियाकार म्हणून लिहितात. निव्वळ प्रतिसादात सहभागी असलेल्या रिटेक्टर्स नेट इऑनरिक अभिक्रियामध्ये लिहिले जातील. उत्पादने प्रतिक्रिया संपल्यावर सर्व घटक संतुलित समीकरणात समाविष्ट केले आहेत.




