ऑक्टेट आणि डुप्लेट दरम्यान फरक | Octet vs Duplet
महत्त्वाचा फरक - ऑक्टेट व्ह्यू डुप्लेट नैसर्गिकरित्या सक्रिय आणि निष्क्रिय अणू किंवा संयुगे असतात. हे गुणधर्म प्रामुख्याने परमाणुंच्या बाहेरील आंतल्या गोलामध्ये असलेल्या विद्युत्कांच्या संख्येवर अवलंबून असतात. अपूर्ण गोळे असणारे अणू स्थिर होण्यासाठी आपली इलेक्ट्रॉन कॉन्फिगरेशन पूर्ण करण्यासाठी सक्रिय होऊ शकतात. निष्क्रिय असलेल्या अणूत पूर्ण इलेक्ट्रॉन कॉन्फिगरेशन आहे; अशा प्रकारे, विशिष्ट परिस्थितींमध्ये जोपर्यंत हे अणू इतर कोणत्याही परमाणुशी प्रतिक्रिया देत नाहीत. नोबेल वायू नेहमी निसर्गात निष्क्रिय असतात. म्हणून, त्यांना निष्क्रिय वायू म्हणून ओळखले जाते. आवर्त वायू आवर्त सारणी मध्ये आठव्या स्तंभ आहेत. याच कालावधीतील इतर घटक (रांग) त्या कालावधीच्या शेवटी अक्रिय वायुचे इलेक्ट्रॉन कॉन्फिगरेशन प्राप्त करतात, जे निसर्गात सर्वात स्थिर स्वरूपात आहे. सक्रिय अणूंनी
ऑक्टेट नियम किंवा डुप्लेट नियम नुसार इलेक्ट्रॉनांची संख्या पूर्ण केली आहे. Octet आणि दुप्पट मधील महत्वाचा फरक हा आहे की octet एक परमाणु किंवा आयन ज्याला बाह्यतम गोलामध्ये जास्तीतजास्त आठ इलेक्ट्रॉन असतात तर दुप्पट हा एक अणू आहे ज्याला बाह्यतम गोलामध्ये जास्तीतजास्त दोन इलेक्ट्रॉन. अनुक्रमणिका 1. विहंगावलोकन आणि महत्त्वाचे अंतर
2 ऑक्टेट 3 एक डुप्लेट 4 म्हणजे काय साइड तुलना करून साइड - ऑक्टेट व्हॅस डुप्लेट5 सारांश
एक ऑक्टेट काय आहे?
एक ऑक्टेट हा एक अणू किंवा आयन आहे जो त्या अणूच्या बाह्य कप्प्यात आठ इलेक्ट्रॉनांचा असतो. हेलिअम वगळता सर्व महान गाड्या आठ इलेक्ट्रॉन्स आहेत आणि निरुपयोगी आहेत. एक उत्कृष्ट गाळल्याची इलेक्ट्रॉन संरचना खालीलप्रमाणे समाप्त होईल.
उदाहरणार्थ, नियोनचे इलेक्ट्रॉन कॉन्फिगरेशन 1s
2
2 से
2
आहे. 2 पी 6
निऑन एक अक्रिय वायू आहे सात, सहा इत्यादी असणारी इतर मूल्ये. बाह्यतम कक्षेत इलेक्ट्रॉन्स बाहेरून इलेक्ट्रॉन्स मिळवून ऑकटसेट नियम पाळतात; काही घटक आहेत एक, दोन, इत्यादी. इंधन हे इलेक्ट्रॉन्स गमावतात आणि जवळच्या निरुपयोगी गॅसचे इलेक्ट्रॉन कॉन्फिगरेशन प्राप्त करतात. परंतु आवर्त सारणीच्या मध्यभागी असलेले अन्य घटक नवीन इलेक्ट्रॉन्स असणारे घटक आहेत ज्यात ते इलेक्ट्रॉन्स शेअर करतात आणि एक ऑक्टेट बनतात.2 से 1 आहे. 2s 1 इलेक्ट्रॉन काढून टाकून ते डुप्लेअर होऊ शकतात. त्या बाबतीत, तो, एच - आणि ली +
डुप्लेट्स आहेत जे स्थिर डुप्लेसमधून अस्तित्वात असू शकतात.
सर्व डुप्लेट्सचे इलेक्ट्रॉन कॉन्फिगरेशन समाप्त करण्याचे प्रकार खालीलप्रमाणे आहेत.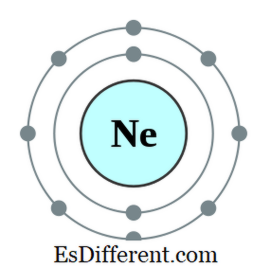
ns
2
आकृती 02: हीलियम, दुप्पट ऑक्टेट आणि डुप्लेटमध्ये काय फरक आहे? - फरक लेख मध्य पूर्व -> ऑक्टेट व्हिप डुप्लेट ऑक्टेटमध्ये आठ विघटनं बाह्यसमावे आहेत. बाह्य दुहेरी शेलमध्ये डुप्लेटचे दोन इलेक्ट्रॉन्स आहेत. सामान्य इलेक्ट्रॉन कॉन्फिगरेशन ऑक्टेटमध्ये ns 2 एनपी 6 शेवटी इलेक्ट्रॉन संरचना टाइप करा. डुप्लेटमध्ये ns 2
शेवटी कॉन्फिगरेशन प्रकार आहे
ऑरबिटल्सची संख्या ऑक्टेटमध्ये किमान दोन ऑर्बिटल्स असू शकतात. दुहेरीमध्ये केवळ एक परिभ्रमण आहे.

ऑरबिटल्सचा प्रकार ऑक्टेटमध्ये सर्व प्रकारचे ऑर्बिटल्स असू शकतात उदा. S, p, d, f, इ.




