एसीटाडाडिहाइड आणि एसीटोनमध्ये फरक | Acetaldehyde vs Acetone
की फरक - Acetaldehyde अॅसीटोनच्या
Acetaldehyde आणि अॅसीटोनच्या दोन्ही लहान सेंद्रिय घटक आहेत, पण त्यांच्या कार्यक्षम गट त्यांना फरक आहे वि. दुसऱ्या शब्दांत, ते भिन्न रासायनिक आणि भौतिक गुणधर्मांसह दोन भिन्न कार्बोनिअल संयुगे आहेत. एसीटोन हा कॅटोन ग्रुपचा सर्वात लहान सदस्य आहे, तर एसीटॅडायहाइड एल्डिहाइड समुहाचा सर्वात लहान सदस्य असतो. महत्त्वाचे अंतर एसेटॅडाडिहाइड आणि एसीटोन दरम्यान कार्बन अणूंची संख्या संरचना मध्ये; अॅसीटोनच्या तीन कार्बन अणू आहे, पण acetaldehyde केवळ दोन कार्बन अणू जास्त आहेत. कार्बन अणूंच्या संख्येतील फरक आणि दोन भिन्न कार्यशील गट त्यांच्या गुणधर्मांमधील इतर अनेक फरकांना सामोरे जातात.
अॅसीटोन म्हणजे काय?
एसीटोन केटोन ग्रुपमधील सर्वात लहान सदस्य आहे, ज्यास प्रोपोनोन म्हणूनही ओळखले जाते. तो एक रंगहीन, अस्थिर, ज्वालाग्रही द्रव आहे जो एखाद्या सॉल्वेंटप्रमाणे वापरला जातो. बहुतेक सेंद्रीय सॉल्व्हन्ट्स पाण्यात विरघळत नाहीत परंतु एसीटोन पाण्यात मिसळतात. हे बर्याचदा प्रयोगशाळेत साफसफाईच्या उद्देशाने आणि नखे पॉलिशच्या पातळ पदार्थांमध्ये मुख्य सक्रिय घटक म्हणून आणि पेंट थर्ड मध्ये वापरले जाते.

ऍसेटलडीहायड, ज्याला
इथानल देखील एल्डिहाइड समूहातील सर्वात लहान सदस्य म्हणून ओळखले जाते. मजबूत घुटमळणार्या वासासह रंगहीन, ज्वालाग्राही द्रव आहे. अॅसेटीक ऍसिड, परफ्यूम, ड्रग्स आणि काही फ्लेवर्स उत्पादन करणारी अनेक औद्योगिक उपयोग आहेत.
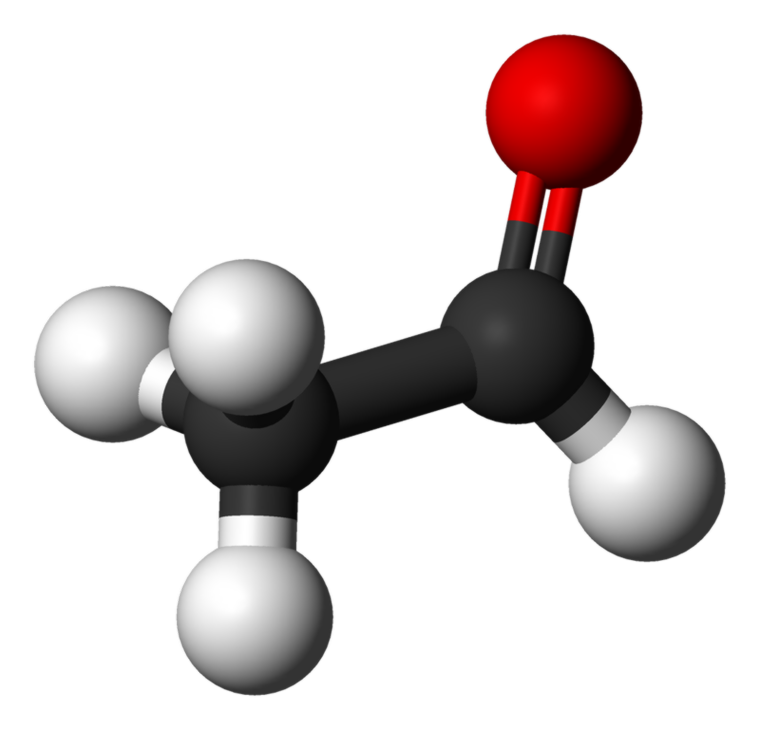
अॅसीटोनच्या रचना आणि सामान्य गुणधर्म:
अॅसीटोनच्या सी च्या आण्विक सूत्र
3 एच 6 कर. ही कार्बन कुटुंबातील सर्वांत सोपा सदस्य आहे. ती झणझणीत गंधाने अस्थिर, ज्वालाग्राही द्रव आहे. Acetaldehyde: acetaldehyde च्या आण्विक सूत्र C

2 एच 4 कर. हे सर्वात सोपा असून अल्डीहाइड कुटुंबातील सर्वात महत्वाचे सदस्य आहेत. खोलीच्या तापमानाला रंगहीन, अस्थिर, ज्वालाग्राही द्रव आहे. अॅसेटॉल्डिहाइड व ऍसीटोनची घटना ऍसीटोन: सर्वसाधारणपणे, एसीटोन हा मानवी रक्त आणि मूत्रात असतो. हे नेहमीच्या चयापचय दरम्यान मानवी शरीरात निर्माण आणि नियुक्त केले जाते. जेव्हा लोकांना मधुमेह आहे, तेव्हा ते मानवी शरीरात मोठ्या प्रमाणावर तयार केले जाते.

Acetaldehyde:
Acetaldehyde नैसर्गिकरित्या निरनिराळ्या वनस्पती (कॉफी), ब्रेड, भाज्या आणि योग्य फळे मध्ये आढळते.याव्यतिरिक्त, तो सिगारेटचा धूर, गॅसोलीन आणि डिझेल एक्झॉस्टमध्ये आढळतो. देखील, तो अल्कोहोल चयापचय मध्ये एक दरम्यानचे आहे एसेलेटलाइहाइड आणि एसीटोनचा वापर एसीटोन: एसिटोनचा उपयोग प्रामुख्याने रासायनिक प्रयोगशाळेतील सेंद्रीय विलायक म्हणून केला जातो आणि रंग उद्योगातील नेल पॉलिश रिमूव्हर तयार करण्यामध्ये सक्रिय घटक आहे.
ऍसेटॉल्डिहाइड: ऍसीटोनचा वापर अॅसिटिक अॅसिड, परफ्यूम, रंगणी, फ्लेवरिंग एजंट्स आणि ड्रग्सचे उत्पादन करण्यासाठी केला जातो. अॅसेटॉल्डिहाइड आणि ऍसीटोनची वैशिष्ट्ये
ओळख ऍसीटोन:
ऍसीटोन आयोडोफॉर्म चाचणीसाठी सकारात्मक परिणाम देते म्हणून, आयोडोफॉर्म चाचणी वापरून एसीटॅडायहायडपासून ते सहजपणे फरक करता येतो. ऍसेटलडिहाइड:
ऍसेटलडीहायड हा "टोलनचा अभिकर्मक" चा चांदीचा मिरर देतो परंतु केटोन्स या चाचणीसाठी सकारात्मक परिणाम देत नाहीत. कारण, ते सहजपणे ऑक्सिडीझ करू शकत नाही. क्रोमिक एसिड चाचणी आणि Fehling च्या अभिकर्मक देखील acetaldehyde ओळखण्यासाठी वापरले जाऊ शकते प्रतिक्रियात्मकता
कार्बोनिअल गटांची (एल्डिहाइड आणि केटोन्स) क्रियाशीलता प्रामुख्याने कार्बोनिएल (सी = हे) गटामुळे आहे.
ऍसीटोन:
साधारणपणे, alkyl गट इलेक्ट्रॉन देणगी गट आहेत. एसीटोनमध्ये दोन मिथाइल गट आहेत आणि कार्बोनिएल गटांचे ध्रुवीकरण कमी केले जाते. म्हणून, तो संयुग कमी प्रतिक्रियाशील करते कार्बोनिएल ग्रुपच्या दोन्ही बाजूंना संलग्न केलेले दोन मिथिल गट देखील अधिक स्टॅरिक बाधीर आहेत. म्हणून, ऍसीटोन एसीटॅडाडिहाइड पेक्षा कमी प्रतिक्रियात्मक आहे. Acetaldehyde:
याउलट, अॅसीटॅडायहायडमध्ये फक्त एक मिथिल गट आहे आणि एक हायड्रोजन अणू कार्बोनिएल ग्रुपला संलग्न आहे. मिथिल गट इलेक्ट्रॉनांना देणगी म्हणून, हायड्रोजन अणू इलेक्ट्रॉन काढून घेतो; यामुळे परमाणू अधिक ध्रुवीय बनतो, आणि त्यास रेणू अधिक क्रियाशील करते. एसीटोनच्या तुलनेत, एसिटॅडिहायडमध्ये कमी stearic प्रभाव असतात आणि इतर रेणू सहजपणे पोहोचू शकतात. या कारणांमुळे, एसीटॅडाडिहाइड एसीटोनपेक्षा अधिक रिऍक्टिव्ह आहे.



