एसिड-बेस टाइटेटेशन आणि रेडॉक्स टायट्रेशन मधील फरक | एसिड-बेस टिटेटेशन विरूद्ध रेडिओक्स टायटेशन
की फरक - ऍसिड-बेस टाइटेटेशन वि. रेडॉक्स टायटेशन
सर्वसाधारणपणे, एका अज्ञात समाधानाची (विश्लेte) प्रमाण निश्चित करण्यासाठी तिचे नाव वापरण्यात आले आहे. सर्वात सामान्यतः वापरले जाणारे दोन titrimetric पद्धती अॅसिड-बेस titrations आणि redox titrations आहेत. एसिड-बेस्ड टेट्रेशन्स आणि रेडॉक्स टायट्रासॅशन दरम्यान प्रमुख फरक टिपट्रिशन आणि विश्लेषक यांच्यात जे घडते त्या प्रतिक्रियाची प्रकृति आहे टाईटेशनमध्ये. ऍसिड-बेस्ड टाटट्रेशन्समध्ये, न्यूट्रललायझेशन प्रतिक्रिया घडते आणि रेडॉक्स टिटेशन्समध्ये, रेडॉक्सची प्रतिक्रिया घेते (एक ऑक्सिडीजिंग प्रतिक्रिया आणि कमी प्रतिक्रिया) अभिक्रियाचा वापर हा प्रतिक्रियाच्या शेवटच्या बिंदुचा निर्धारित सर्वात सामान्यतः वापरली जाणारी पद्धत आहे.
अॅसिड-बेस शीर्षक मिळवणे म्हणजे काय?अॅसिड-बेस टिटेशन्समध्ये, एसिड (अम्लीय टिटस्ट्रेशन) किंवा बेस (मुळ टायट्रासन) हे नाविक म्हणून वापरले जाते. Acidic titrations मध्ये वापरले जाणारे एसिडचे उदाहरणे म्हणजे H
2 SO 4 , एचसीएल, किंवा एचएनओ 3 मुख्यतः वापरल्या जाणार्या मूलभूत शुल्कास NaOH, K 2 CO 3 किंवा Na 2 CO 3 ऍसिड आणि बेस यांच्या ताकदीवर आधारित अॅसिड-बेस्ड टाटट्रेशनचे वर्गीकरण खालीलप्रमाणे केले जाऊ शकते.
- कमकुवत आम्ल - कमकुवत बेस टिटेशन्स
- -बेस टाईपेटेशन, प्रतिक्रिया शेवटच्या बिंदूला निर्धारित करण्यासाठी निर्देशक वापरतात. वरील निर्देशित केलेल्या टाइटट्रिशनच्या प्रकारावर अवलंबून वेगवेगळे निर्देशक वापरले जातात.
- रेडॉक्स टायट्रेशन म्हणजे काय?
रेडॉक्स टायट्रास्ट्रम मध्ये रेडॉक्स प्रक्रिया असणे आवश्यक आहे. रेडॉक्सच्या प्रतिक्रियामध्ये दोन प्रतिक्रिया आहेत; एक ज्वलन प्रतिक्रिया आणि कमी प्रतिक्रिया. ऑक्सिडेशन आणि कपात प्रक्रिया दोन्ही एकाच वेळी घडतात, जेथे आम्हाला प्रतिक्रिया पूर्ण करण्याचे निर्धारित करण्याची परवानगी दिली जाते. हे अनुवांशिकतेचे शेवटचे बिंदू म्हणून देखील ओळखले जाते. याचे निर्धारण अनेक प्रकारे केले जाऊ शकते; सूचक इलेक्ट्रोड, रेडॉक्स निर्देशक (सूचक ऑक्सिडेशन-कपात राज्य) यावर वेगवेगळ्या रंगाची निर्मिती करतो आणि नॉन-रेडॉक्स निर्देशक वापरतात (निर्देशक अधिक रंगीबेरंगी रक्कम जोडतात तेव्हा रंग तयार करतो).
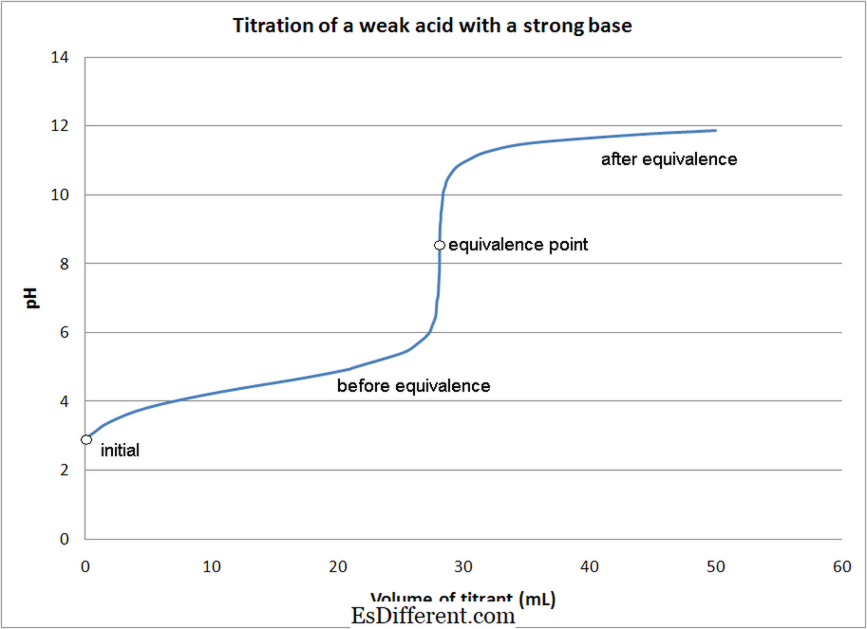
प्रतिक्रियांचे स्वरूप: ऍसिड-बेस टाइटेटेशन: अॅसिड-बेस टिट्रेशनमध्ये विश्लेषक (अज्ञात एकाग्रतासह उपाय) आणि अम्लीय किंवा मूलभूत मूलतत्त्वे यांच्यामध्ये निष्क्रियता प्रतिक्रिया समाविष्ट असते.
रेडॉक्स टायट्रेशन:

रेडॉक्स अभिक्रियामध्ये विश्लेषक आणि तीक्ष्ण यांच्यातील ऑक्सिडेशन आणि कमी करण्याची प्रक्रिया समाविष्ट असते. कोणताही घटक असा नाही की घटक oxidizes आणि कमी जे. एकतर ववश्लेषण ककंवा मथिताचा ऑक्सिडइज केला तर उर्वरित घटक त्यानुसार कमी होतो.
समाप्ती बिंदूचे निर्धारण: ऍसिड-बेस शीर्षक:
साधारणतया, पीएच निर्देशक, पीएच मीटर किंवा आचार-मापण मीटरचा वापर अॅसिड-बेस टिट्रीशनच्या शेवटच्या बिंदूला निर्धारित करण्यासाठी केला जातो. रेडॉक्स टायटेशन:
रेडॉक्स प्रतिक्रियांचा शेवटचा बिंदू ठरवण्याकरता सर्वात सामान्यतः वापरले जाणारे तंत्र एक पोटॅनटिओमीटर किंवा रेडॉक्स इंडिकेटर वापरत आहे. परंतु, बहुतेक वेळा विश्लेषक किंवा ग्रंथकाराने अंतिम पॉईंटवर एक रंग तयार केला. म्हणून त्या प्रकरणांमध्ये अतिरिक्त निर्देशक आवश्यक नाहीत. उदाहरणे: ऍसिड-बेस शीर्षक:
- फरक लेख मध्यम पूर्वी टेबल ->
प्रकार प्रतिक्रिया (सूचक)
मजबूत ऍसिड - मजबूत आधार पदच्युती एचसीएल + NaOHàNaCl + एच
2
ओ (फेनोल्फिथेलिन / मिथेल नारंगी)
मजबूत ऍसिड - कमकुवत बेस पदवीदानता| एचसीएल + एनएच | 3 |
| एनएएच | 3 क्ल (मेथिल ऑरेंज) कमकुवत अम्ल - मजबूत बेस परिमाण |
| सीएच | 3 सीओओएचएचएच + नाओएचएचएएचएच 3 COONA + एच 2 |
| ओ (फेनोल्फिथेलिन) | कमजोर एसिड-बेस बेस टाइटट्रेशन सीएच 3 COOH + NH 3 एसीएच 3 |
| सीओओओ | - + NH 4 + (योग्य निर्देशक नाहीत) रेडॉक्स टाइटेटेशन: 2 के.एम.एन.ए 4 +5 एच 2 सी 2 ओ 4 + 6 एचसीएल → 2 MnCl |
2
+ 2KCl + 10 CO 2 + 8 H 2 हे (+7) (+3) (+2) (+ 4) वरील प्रतिक्रिया मध्ये, ऑक्सालिक एसिड ऑक्सिडित असताना परमॅनेटनेट कमी होते. जेव्हा प्रतिक्रिया पूर्ण होते, परांजनाटचा जांभळा रंग रंगहीन होतो. केएमएमओ 4 + 5 एफईसीएम 2 + 8 एचसीएल → 5 एफईसीएम 3 + एमएनसीएल 2 + केएल +4 एच 2 ओ (+7) (+2) (+3) (+2) प्रतिमा सौजन्याने:
1 क्वांटमकिनेटिक्स (स्वयंव्यावसायिक) [सीसी बाय 3. 0], विकिमिडिया कॉमन्स 2 द्वारे, मजबूत आधार असलेल्या कमजोर एसिडचे Titration विलॉड द्वारे "विन्कलर टायटेशन प्री टाइटेटरी" [सीसी बाय-एसए 3. 0] कॉमन्स मार्गे




