फेरस ग्लुकॅनेट आणि फेरस सल्फेट दरम्यान फरक
फेरस ग्लुकॉनेट वि फेरस सल्फेट लोखंड हे प्रतीक एफई सह डी ब्लॉकमधील एक धातू आहे. हे पृथ्वीला बनविणारे सर्वात सामान्य घटक आहे आणि पृथ्वीच्या आतील आणि बाहेरील कडांमध्ये मोठ्या प्रमाणात आहे. पृथ्वीच्या पपळ्यात हा चौथा सर्वात सामान्य घटक आहे लोहमध्ये ऑक्सिडेशन राज्ये आहेत - 2 ते +8 पर्यंत यापैकी +2 आणि +3 फॉर्म हे सर्वात सामान्य आहेत. +2 लोहाचा ऑक्सीडीशन फॉर्म फेरोस म्हणून ओळखला जातो आणि +3 फॉर्म फेरिक म्हणून ओळखला जातो. हे आयन हे ionic क्रिस्टल्सच्या रूपात आहेत, जे विविध आयनोत्पादनांनी तयार केले आहेत. विविध कारणांसाठी जैविक व्यवस्थेसाठी लोह आवश्यक आहे उदाहरणार्थ, मानवांमध्ये, हिमोग्लोबिनमध्ये फेररलाला चीलेटिंग एजंट म्हणून आढळले आहे. वनस्पतींमध्ये क्लोरोफिल संश्लेषणासाठी हे देखील महत्त्वाचे आहे म्हणूनच जेव्हा या आयनची कमतरता असेल तेव्हा जैविक प्रणाली विविध रोग दर्शविते. फेरस ग्लुकोनेट आणि फेरस सल्फेट हे दो-आयनिक संयुगे आहेत जे जिवंत प्रणालींमध्ये लोह कमतरतेवर मात करण्यासाठी फेरस पूरक म्हणून दिले जाऊ शकते.
फेरस ग्लुकोनेटग्लुकोनिक ऍसिडचे एक लोखंड लवण फेरस ग्लुकोनेट म्हणून ओळखले जाते. ग्लुकोनिक अॅसिडचा कार्बोक्झिलिक ऍसिड ग्रुप हा मीठ बनविण्यासाठी फेरसशी संबंधित आहे. या मिठाचा उत्पादन करताना दोन ग्लूकोनेट आयन हे फेरस आयन बरोबर संवाद साधत आहेत. त्याच्याकडे आणीबाणीचा सूत्र आहे C
12 H 24 FeO 14 कंपाऊंडचे दाढेदार वस्तुमान 448 आहे. 15. फेरस ग्लुकोनॅटची खालील रचना आहे.
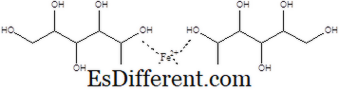
फर्गोन, फेरेलॅट, आणि सिमॉन सारख्या ब्रांड नावांप्रमाणेच विकले जाते. हायपोचोमिक ऍनीमिया सारख्या आजारांमुळे, शरीरात लोह नसल्यामुळे होणा-या लोहामुळे फेरस ग्लुकोनेट दिले जाते. पुढे, फेरस ग्लुकोनॅटचा वापर अन्नातील मिश्रित पदार्थ म्हणून केला जातो.
सह आयनिक संयुग आहे. हे विविध प्रकारचे क्रिस्टल प्रकारात अस्तित्वात असू शकतात जे जलक्रियांचे प्रमाण प्रमाणित करतात. त्यात निर्जल पदार्थ, मोनोहाइड्रेट, टेट्राहाइड्रेट, पेंटायहाइड्रेट, हेक्झिहाइड्रेट आणि हेप्टायहाइड्रेट फॉर्म आहेत. यांपैकी, निळा, हिरवा रंग हेप्टायहाइड्र फॉर्म हा सामान्य आहे. मोनोहाइड्रेट, पेंटायहाइड्रेट आणि हेक्हाहायड्रेट फॉर्म तुलनेने दुर्मिळ असतात. निळा, हिरवा रंग क्रिस्टल्स व्यतिरिक्त, फेरस सल्फेटचे इतर प्रकार पांढरे रंगाचे क्रिस्टल्स आहेत. हायड्रेटेड क्रिस्टल्स फ्लेक्स वॉटरला गरम केल्यावर आणि निर्जल सॉलिड झाल्यानंतर. पुढील गरम वर, हे सल्फर डायऑक्साइड, सल्फर ट्रॉयॉक्साइड आणि लोहा (III) ऑक्साईड (लालसर तपकिरी रंग) मध्ये विघटित आहे.ते गंधरहित क्रिस्टल्स आहेत. फेरस सल्फेट सहजपणे पाण्यात विसर्जित करतो आणि त्या प्रकरणात फेरस आयन हेक्सा एक्वा कॉम्प्लेक्स बनतो [Fe (H
2 O) 6 ] 2+ फेरस सल्फेटचा वापर लोह कमतरतेच्या ऍनेमीया सारख्या लोह कमतरतेच्या परिस्थितीचे उपचार करण्यासाठी केला जातो. मानवासाठीच नव्हे तर वनस्पतींनाही ते जोडले गेले आहे. लोह क्लोरोसीस यासारख्या परिस्थितीमध्ये, जेथे वनस्पती पिवळ्या होतात, फिकट पिवळ्या रंगाचे लोह दिले जाते. त्याव्यतिरिक्त इतर संयुगे संश्लेषित करण्यासाठी ते अग्रगण्य आहे. तो एक कमी एजंट असल्यामुळे, हे रेडॉॉक्सच्या प्रतिक्रियांसाठी तसेच वापरले जाते. फेरस ग्लुकोनेट आणि फेरस सल्फेट मध्ये कोणता फरक आहे? • फेरस ग्लुकोनेटमध्ये, फेरस आयनॉनला सेंद्रीय आयनिऑनसह एकत्र केले जाते. फेरस सल्फेट मध्ये, आयन ही अकार्यक्षम आहे. • फेरस ग्लुकोनेट हे फेरस सल्फेटच्या तुलनेत मोठे संयुग आहे. फेरस ग्लुकोनेटच्या तुलनेत लौरस सल्फॅट मुबलक प्रमाणात आहे • पूरक म्हणून दिले जाते तेव्हा, फेरस ग्लुकोनेट हे फेरस सल्फेटपेक्षा जास्त आपल्या शरीरात शोषले जाते.




