आंशिक प्रेशर आणि बाष्प प्रेशर यांच्यात फरक
आंशिक दाब आणि वाफ दाब सामान्यतः वापरले जातात शास्त्रोक्त्यपूर्ण नियम म्हणजे प्रणालीच्या घटकांद्वारे लागू केलेल्या दबाव संख्येशी संबंधित, परंतु त्यांची ओळख इतरांना गोंधळात टाकू शकते. त्यांच्या प्रभाव आणि ओळखीसह या अटींमधील स्पष्ट फरक आहे. हा लेख या अटींमधील फरकांबद्दल अधिक स्पष्ट होईल. त्यात काही उदाहरणे देखील समाविष्ट आहेत ज्यायोगे त्यातील अनुप्रयोगांचे विघटन करणे शक्य होईल.
आपण बाष्प आणि अंशत: दाब यांच्यातील फरक शोधून जाण्यापूर्वी दबाव या संकल्पनेवर प्रकाश टाकूया. एखाद्या वस्तू किंवा वस्तूवर प्रति युनिट क्षेत्रास लागू केलेले बल म्हणून शास्त्रीय परिभाषित केले आहे. हे परस्पर एकमेकांशी जोडलेल्या कणांद्वारे लागू केलेले बल म्हणून देखील परिभाषित केले जाऊ शकते आणि ते पास्कलद्वारे मोजले जाते. कणांच्या टकयांच्या बाबतीत, गॅस समीकरण आणि गियॉंकेटची गती मिळविण्याचे सिद्धांत वापरला जातो.
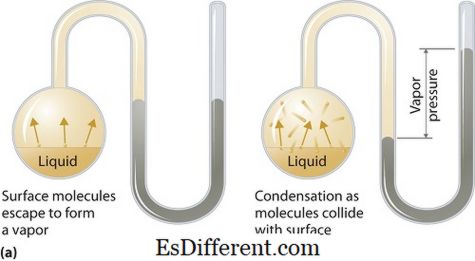
वाफ दाब म्हणजे काय? < वापाचा दबाव द्रव किंवा घनकचरा टप्प्यांवर लागू होऊ शकतो. वाफ आणि द्रव (सॉलिड) दोन्ही संपर्कात असताना बंद प्रणालीत दिलेल्या तापमानामध्ये त्याच्या द्रव किंवा घनव्या अवस्थेत त्याच्या उष्मादायी समतोलतेमध्ये वाष्पाने दबाव टाकला आहे. बाष्पीभवन परिणामी हे दाब उद्भवतात, जे सॉलिड किंवा द्रव वर वाढीव तापाने सक्षम आहे. त्यामुळे तपमान बाष्पाने मोजण्याचे माप म्हणून वापरले जाते आणि ते वाफ दाब थेट प्रमाणबध्द आहे. याचा अर्थ, उच्चतर तपमान हा बाष्पीभवन आहे.
राऊल्ट्स लॉ द्वारे स्पष्ट केल्याप्रमाणे वाफेवरचा दबाव आदर्श मिश्रणावर देखील होऊ शकतो. हे असे म्हणते की एखाद्या द्रव किंवा घन मिश्रण मध्ये एका विशिष्ट घटकाचे अंशतः भाप दाब त्या तापमानाच्या वाफ दाबाप्रमाणे असतो जो त्या तापमानात त्याच्या मिश्रणिक अंशाने गुणाकार करते. खालील उदाहरणामध्ये हे स्पष्ट होईल.
उदाहरण 1. < 0 चे एक आदर्श मिश्रण दिले. 5 मॉल. इथेनॉल आणि 1. 5 मॉल. मेथनॉल 30 किलो पंप आणि 52 केपीए च्या बाष्पीभवनाने, प्रत्येक घटकाचा आंशिक बाष्पीस दाब निर्धारित करतो.
ऊत्तराची:
सोलिकांची एकूण संख्या 1. 5mol + 0. 5mol = 2. 0mol आहे. राऊल्टच्या नियमानुसार, आंशिक बाष्पाचा दाब त्या विशिष्ट घटकांच्या दाताच्या अंशाने गुणाकार केलेल्या वाफ दाब समान असतो.या प्रकरणात, पी
मेथनॉल
= 1. 5/2 * 52 = 39 केपीए आणि पी इथेनॉल = 0. 5/2 * 30 = 7. 5 केपीए जेव्हा मिश्रणातील घटकांवरील आंशिक वाफेचे दाब आपणास असतील, तेव्हा आपण त्यांना एकत्र जोडून संपूर्ण वाफ दाब मिळवू शकता. या संदर्भात, 7. 5 + 39 46 देते. 5 केपीए इथेनॉल आणि मेथनॉल द्रावणांच्या मिश्रणास संपूर्ण वाफ दाब. वाफ दाब प्रभावित करणारे घटक
आण्विक ओळख < जसे वर सांगितल्याप्रमाणेच, आण्विक शक्तींचे प्रकार वापरत असलेल्या वाफ दाबचे प्रमाण निश्चित करतात. जर सैन्यांची ताकद अधिक असते, तर कमी वाफ दाब येते आणि कमकुवत झाल्यास अधिक वाफ दाब येते. म्हणून द्रव किंवा घनफळांची रचना वाफ दाबवर परिणाम करेल.
तापमान
उच्च तापमान उच्च बाष्प-दाब वाढते कारण हे आण्विक सैन्या तोडून अधिक गतिज ऊर्जा सक्रिय करते जेणेकरून रेणू द्रव पृष्ठभागावर पटकन बाहेर पडू शकतात. वाफ दाब (भरल्यावरची वाफ दाब) बाह्य दबाव (वातावरणाचा दाब) च्या बरोबरीने तर द्रव उकळण्यास सुरू होईल. कमी तपमान कमी वाफ दाब होईल आणि द्रव उकळणे यासाठी वेळ लागेल.
डाल्टनचा आंशिक दाव्यांचा कायदा
आंशिक दबाव म्हणजे काय? < आंशिक दबाव कल्पना प्रथम प्रसिद्ध शास्त्रज्ञ जॉन डाल्टन यांनी प्रस्तावित केली त्याच्या आंशिक दबावांचे नियम जन्माला आले ज्यामध्ये असे म्हटले आहे की वायूचा आदर्श मिश्रण असलेल्या संपूर्ण दबाव वैयक्तिक वायूच्या आंशिक दबावांच्या समयावधि आहे. एक विशेष कंटेनर हायड्रोजन, नायट्रोजन आणि ऑक्सिजन वायू भरले आहे म्हणा, एकूण दबाव, पी < एकूण,
ऑक्सिजन, नायट्रोजन आणि हायड्रोजनच्या समतुल्य असेल. त्या मिश्रणातील कोणत्याही वायूचे अंशतः दाब हे वैयक्तिक वायूच्या मोजार अर्काने एकूण दबाव वाढवून मोजले जाते.

थोडक्यात, अंशत: दाब हे एका विशिष्ट वायूच्या मिश्रणाने वापरले जाणारे दबाव आहे जसे की ते केवळ यंत्रामध्येच काम करत होते. अशा प्रकारे आपण वैयक्तिक वायूचे आंशिक दबाव ठरवताना इतर वायूकडे दुर्लक्ष करतो. हे सिद्धांत इंजेक्शनद्वारे, 0 असे म्हणतात. 0.10 टन ओ < 2
ते 10 0 लि. कंटेनर 230K वर आणि नंतर इंजेक्शनद्वारे 0. 4atm N
2 एक समान कंटेनर मध्ये त्याच तपमानावर त्याच आकाराचे, आणि नंतर अखेरीस एकूण दबाव मोजण्यासाठी वायू एकत्र; ती दोन वायूंची बेरीज असेल. हे स्पष्टपणे गैर-प्रतिक्रियाशील वायूंचे मिश्रण असलेल्या एका व्यक्तिगत वायूचे आंशिक दबाव स्पष्ट करते. आंशिक दबाव गणना करणे
डाल्टनचे नियम [1] ही तरतुदी पुरविण्यापासून आंशिक दबाव ठरते. हे प्रदान केलेल्या विशिष्ट माहितीवर अवलंबून असेल. जर, उदाहरणार्थ, गॅस ए आणि बी चे मिश्रण तसेच एकूण गॅस एच्या मिश्रणासाठी एकूण दबाव दिले जाते तर B चे आंशिक दबाव P TOTAL = P ए < + पी < बी बाकीचे बीजगणित कुशल हाताळणी आहेत. पण अशा परिस्थितीत जेव्हा मिश्रणाचा एकूण दबाव दिला गेला आहे, आपण निर्धारित करण्यासाठी गॅस बी च्या दाएं अपूर्णांक वापरू शकता हे अंशतः दाब आहे.डायलर अपूर्णांक, एक्स द्वारे दर्शविलेले, गॅस मिश्रणाचे संपूर्ण मिश्रण करून गॅस बीच्या moles विभाजित करून आढळू शकते. नंतर आंशिक दाब शोधण्यासाठी आपण संपूर्ण दाब करून मोडर अपूर्णांक, एक्स ला गुणाकार कराल. खालील उदाहरण तपशीलवार
उदाहरण 2.
नायट्रोजन व ऑक्सिजन यांचे मिश्रण, 2. 5 moles आणि 1. 85 moles अनुक्रमे, 20 मध्ये इंजेक्शन दिले जाते. 0 लि. कंटेनर 4TM च्या एकूण दाबाने; ऑक्सिजन गॅस द्वारे अंशतः अंशतः दबाव टाकतात. ऊत्तराची: मिश्रणात एकूण moles 2 आहे. 5 + 1 = 85 = 4. 35 moles. तर ऑक्सिजन, एक्स < ओ < हा डायलर अपूर्णांक 1. 85 moles / 4 असेल. 35 moles = 0. 425 moles. ऑक्सिजनचा अंशत: दबाव 0 असेल. 425 * 4ॅट = 1 7. उर्वरित गॅसचा अंशत: दाब त्याच पद्धतीने मोजला जाऊ शकतो किंवा ऑक्सिजन गॅस आणि डाल्टन यांच्या आंशिक दबावाच्या नियमाने विस्तारित केलेल्या एकूण दबावाचा वापर करून गणना केली जाऊ शकते की गैर-प्रतिक्रियाशील वायूचे एकूण दाब हे बेरजेच्या समान आहे. आंशिक दबाव. वाफ आणि आंशिक दाब मधील फरक वरील स्पष्टीकरणांवरून, हे स्पष्ट आहे की वाफ दाब आणि आंशिक दबाव दोन भिन्न दबाव आहेत. वाफेवरचा दबाव द्रव आणि घन पदार्थांवर लागू होतो, तर अंशत: दाब वायूजन्य टप्प्यावर लागू होतो. वातावरणामध्ये पुरेसा उष्णता जोडण्यात आल्यानंतर फॉरेचा संक्रमणामध्ये बाष्पीभवन केले जाते त्यामुळे त्यांचे परमाणु एखाद्या बंद यंत्रणा बाहेर पडू शकतात. आंशिक दाब आणि वाफ दाब यात मुख्य फरक असा आहे की आंशिक दबाव म्हणजे एखाद्या विशिष्ट वायूच्या मिश्रणाने त्या प्रणालीमध्ये एकटाच असतो, तर वाफेवरचा दबाव तिच्यात वाफाने व्यापलेला दबाव होय. द्रव किंवा घन च्या त्याच्या घनरूप राज्य सह उष्मादायी समतोल. खालील तक्ता या दबावांमधील संक्षिप्त तुलना देतो. बाष्प प्रेशर
आंशिक प्रेशर
हे द्रव किंवा घन पदार्थ वायू द्वारा समतोल अवस्थेत टिकाव केले जाते
वैयक्तिकरित्या गॅसमध्ये गैर-प्रतिक्रियात्मक वायुंचे मिश्रण वापरले जाते
रूऑल्टचे वर्णन लॉ < वेल डाल्टन यांचे नियम करून स्पष्ट केले घन आणि द्रव टप्प्यामध्ये लागू वायूजन्य टप्प्यात केवळ लागू
पृष्ठभागावरील क्षेत्रफळ किंवा सिस्टमचे खंड < त्याच बरोबर वायू वापरून गणना केली जाते. व्हॉल्यूम
सॉल्टचा मोल अपूर्णांक वापरुन मोजणी करा < वायूचे तीळ भाग वापरुन गणना करा
ओघ वळवा!


